研究内容の紹介
消化器系や呼吸器系などの上皮細胞は体外と体内を仕切る境界となっている。上皮細胞の細胞膜は、体外に通じる管腔側 (apical) と体内に面した側底膜側 (basolateral) でタンパク質の構成が異なり極性が生じている。
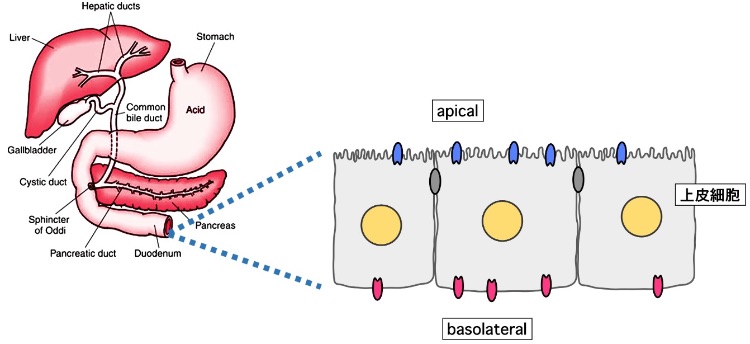
細胞膜で異物排出ポンプとしてはたらくABCC1とABCC2は類似した構造をもつが、basolateral側に局在化するABCC1に対してABCC2はapical側に局在化し、各々が正しい極性で細胞膜に局在化することで上皮細胞での物質輸送の方向性が確立される。両者の極性局在化を決定するシグナル配列を探索する多くの研究が試みられたが、いずれも明確な配列を求めることが出来ていなかった。
そこで私たちの研究グループは、細胞内で過剰発現させたペプチド断片による極性局在化の撹乱効果を指標にした独自のシグナル評価実験系を構築し、ABCC2をapical側の細胞膜へ局在化させるシグナル配列(S283QDAL287)を見出すことに成功した。また、ABCC1のbasolateral側細胞膜への局在化シグナル(L300I301)も同定した。これらの発見を踏まえて、構造の似たABCC1とABCC2の極性局在化を制御するメカニズムを明らかにすることを次の目標にしている。
【参考文献】Emi et al. J. Cell Sci.125, 3133-3143 (2012)、Emi et al. BBRC, 441, 89-95 (2013)
ABCC2は肝臓や小腸で発現し、ビリルビンやステロイドなどの生体物質や多種の外来性物質の代謝物をapical側の管腔に排出する。細胞の中で新たに生合成されたABCC2が細胞膜のapical側に局在化する過程について、制御機構の詳細は不明である。まず始めに、apical側の細胞膜で異物排出ポンプとしてはたらくABCC2の極性局在化に焦点を絞り、ABCC2の極性局在化を規定するシグナル配列と特異的に結合するタンパク質によるABCC2の極性局在化制御を明らかにすることを目的としている。
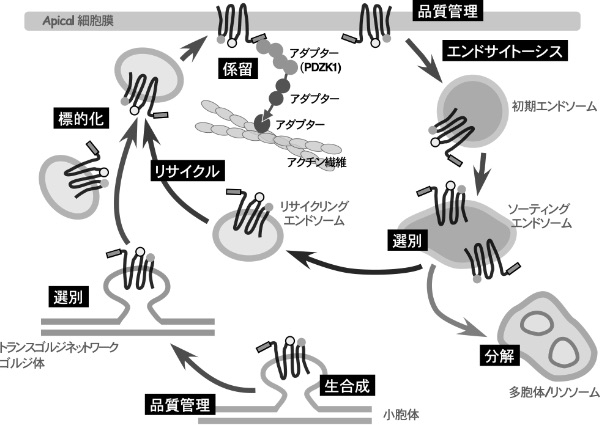
最終的には、ゴルジ体以降の細胞内膜系でのABCC2の選別機構と極性局在化に始まり、細胞膜に到達したABCC2を膜に係留する機構や、細胞膜での品質管理、細胞内に取り込まれたABCC2の細胞膜へのリサイクリング、役割を終えたABCC2の分解系への選別など、一連の細胞内動態の制御を解明する研究を構想している。ABCC1などの他の輸送体を対象にした研究成果と併せ、上皮細胞の細胞膜ではたらく膜タンパク質の極性局在化の制御機構の全体像を解明することを目指して研究を展開している。
社会にとって何の役に立つのか?
ABCC2は肝臓や小腸ではたらく異物排出ポンプであり、ABCC2の欠損が高ビリルビン血症や薬物による肝障害の多発を伴うDubin-Johnson症候群の原因となる。また、ABCC2の発現亢進が腫瘍細胞の抗癌剤への耐性獲得に寄与している。本研究の成果が、ABCC2の局在化制御の破綻により起きる疾患や薬剤耐性獲得のメカニズムを明らかにすることに展開し、医療の向上などの面で社会に貢献することが期待される。
